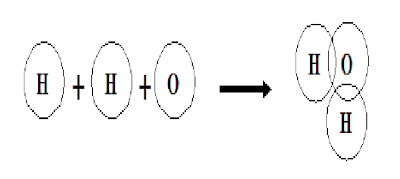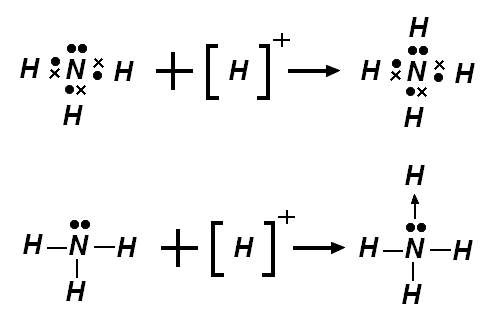
วันจันทร์ที่ 5 กันยายน พ.ศ. 2554
พันธะโคออร์ดิเนตโคเวเลนต์(Coordinate Covalent Bonding)
พันธะโคออร์ดิเนตโคเวเลนต์(Coordinate Covalent Bonding) เป็นพันธะเคมีที่เกิดจากอะตอมของธาตุชนิดหนึ่งให้อะตอมของธาตุอีกชนิดหนึ่งใช้คู่อิเล็กตรอนวงนอกสุดของตัวเองทั้ง 2 ตัว ใช้สัญลักษณ์ในสูตรโครงสร้างแบบเส้นเป็นลูกศร ซึ่งพันธะนี้เรียกชื่ออีกอย่างว่า พันธะเดทีฟ (Dative Bond) ซึ่งพบในสารประกอบหลายชนิด พันธะชนิดนี้ไม่แตกต่างจากพันธะโคเวเลนต์ธรรมดาในทางเคมี
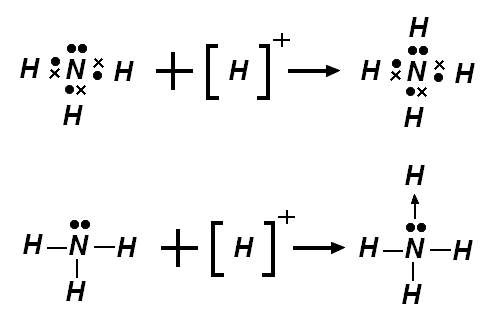
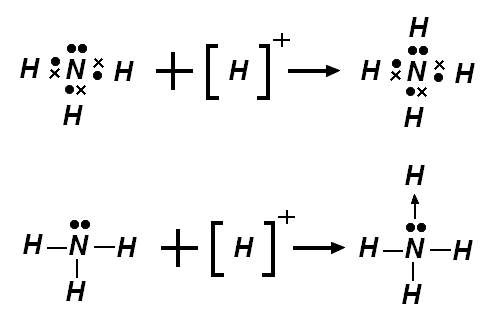
พันธะไฮโดรเจน (Hydrogen bond)
พันธะไฮโดรเจน (Hydrogen bond) คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก ทั้งนี้เนื่องจากพันธะที่เกิดขึ้นนี้อิเล็กตรอนคู่รวมพันธะจะถูกดึงเข้ามาใกล้อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง มากกว่าทางด้านอะตอมของไฮโดรเจนมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจนชึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็น พันธะไฮโดรเจน
โครงสร้างของน้ำที่เป็นของเหลว เกิดจากโมเลกุลของน้ำหลายๆโมเลกุลยึดกันด้วยพันธะไฮโดรเจน แต่ว่ายังไม่ค่อยเป็นระเบียบนักเนื่องจากโครงสร้างของน้ำมีส่วนหนึ่งดึงดูดกันอยู่ด้วยแรงขั้วคู่-ขั้วคู่ และ การสร้างและสลายพันธะไฮโดรเจนตลอดเวลา โครงสร้างของน้ำ (ของเหลว) แสดงได้ดังรูป
แรงยึดเหนี่ยวระหว่างโมเลกุลทั้ง 3 ชนิดนี้ พันธะไฮโดรเจนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงที่สุด ขณะที่แรงลอนดอนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงน้อยที่สุด และทั้ง 3 แรงนี้แข็งแรงน้อยกว่าพันธะโคเวเลนต์ พันธะไออนิก และพันธะโลหะมาก
พันธะโลหะ(Metallic bond)
พันธะโลหะ (Metallic bond) คือ แรงดึงดูดระหว่างไอออนบวกซึ่งเรียงชิดกันกับอิเล็กตรอนที่อยู่โดยรอบ หรือเป็นแรงยึดเหนี่ยวที่เกิดจากอะตอมในก้อน โลหะใช้เวเลนซ์อิเล็กตรอนทั้งหมดร่วมกัน อิเล็กตรอนอิสระเกิดขึ้นได้ เพราะโลหะมีเวเลนซ์อิเล็กตรอนน้อย และมีพลังงานไอออไนเซชันต่ำ จึงทำให้เกิดกลุ่มของอิเล็กตรอน และไอออนบวกได้ง่าย
ในพันธะโลหะอิเล็กตรอนไม่ได้เป็นของอะตอมใดอะตอมหนึ่งเพียงอะตอมเดียว แต่อิเล็กตรอนทุกตัวสามารถเคลื่อนที่ไปยังอะตอม ใกล้เคียงได้ซึ่งแตกต่างจากพันธะโควาเลนต์ ทั้งนี้เพราะแต่ละอะตอมในแท่งโลหะจะมีอะตอมอื่นอยู่โดยรอบ 8 หรือ 12 อะตอมอะตอมจึงมีเวเลนซ์อิเล็กตรอนไม่พอที่จะทำให้เกิดคู่ของอิเล็กตรอนที่ใช้ร่วมกันแต่ละอะตอมกับอะตอมใกล้เคียงได้

• สาเหตุของการเกิดพันธะโลหะ 1. โลหะมีค่าพลังงานไอออไนเซชั่นต่ำมาก แสดงว่าอิเลคตรอนของโลหะจะหลุดออกไปได้ง่าย เมื่อวา
เลนซ์อิเลคตรอนหลุดออกไป ก็จะเหลืออนุภาคบวกดังนี้

อะตอมโลหะทุกอะตอมจะเป็นตัวให้อิเลคตรอนทั้งสิ้นดังนั้นจะไม่มีอะตอมใดเลยที่ได้รับอิเลคตรอน
2. โลหะมีเวเลนซ์อิเลคตรอนน้อย ดังนั้นอิเลคตรอนที่หลุดออกไป จะมีเพียง 1, 2 หรือ 3 ตัวต่อ
อะตอม เท่านั้น
3. โลหะมีค่าโคออร์ดิเนชั่นนัมเบอร์สูง ซึ่งเท่ากับ 8 หรือ 12 หมายความว่า อะตอมหนึ่งจะมีอะตอม
อื่นรอบล้อม 8 ถึง 12 อะตอม ดังนั้นการนำอิเลคตรอนมาใช้ร่วมกันเป็นอิเลคตรอนคู่ในลักษณะของพันธะ
โคเวเลนท์จึงเป็นไปไม่ได้
ดังนั้นการเกิดพันธะโลหะควรเป็นไปในลักษณณะที่ว่า เวเลนซ์อิเลคตรอนของอะตอมโลหะที่หลุดออกไปจะไม่เป็นของอะตอมใดอะตอมหนึ่งโดยเฉพาะ แต่จะเป็นของอะตอมทั้งหมด โดยที่อิเลคตรอนจะเคลื่อนที่ไปยังอะตอมนี้บ้าง อะตอมโน้นบ้าง ในผลึกของโลหะจึงเป็นการเอาอนุภาคบวกมาเรียงกันไว้อย่างมีระเบียบ และมีเวเลนซ์อิเลคตรอนเคลื่อนที่ไปมาได้ทั่วอนุภาคบวกเหล่านั้นเหมือนกับเป็นหมอกปกคลุมอนุภาคบวกทั้งหมด หรืออาจกล่าวได้ว่า อนุภาคบวกเหล่านั้นจมอยู่ในทะเลอิเลคตรอน แรงดึงดูดระหว่างอนุภาคบวกกับอิเลคตรอนเรียกว่า "พันธะโลหะ" ซึ่งมีแรงยึดเหนี่ยวระหว่างพันธะแข็งแรงมาก

3.1 สมบัติของโลหะ
1. โลหะเป็นตัวนำไฟฟ้าที่ดี เพราะอิเล็กตรอนเคลื่อนที่ได้ง่าย
2. โลหะมีจุดหลอมเหลวสูง เพราะเวเลนต์อิเล็กตรอนของอะตอมทั้งหมดในก้อนโลหะยึดอะตอมไว้อย่างเหนียวแน่น
3. โลหะสามารถตีแผ่เป็นแผ่นบางๆได้ เพราะมีกลุ่มเวเลนต์อิเล็กตรอนทำหน้าที่ยึดอนุภาคให้เรียงกันไม่ขาดออกจากกัน
4. โลหะมีผิวเป็นมันวาว เพราะกลุ่มอิเล็กตรอนที่เคลื่อนที่โดยอิสระมีปฏิกิริยาต่อแสง จึงสะท้อนแสงทำให้มองเห็นเป็นมันวาว
5. สถานะปกติเป็นของแข็ง ยกเว้น Hg เป็นของเหลว
6. โลหะนำความร้อนได้ดี เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทาง

ในพันธะโลหะอิเล็กตรอนไม่ได้เป็นของอะตอมใดอะตอมหนึ่งเพียงอะตอมเดียว แต่อิเล็กตรอนทุกตัวสามารถเคลื่อนที่ไปยังอะตอม ใกล้เคียงได้ซึ่งแตกต่างจากพันธะโควาเลนต์ ทั้งนี้เพราะแต่ละอะตอมในแท่งโลหะจะมีอะตอมอื่นอยู่โดยรอบ 8 หรือ 12 อะตอมอะตอมจึงมีเวเลนซ์อิเล็กตรอนไม่พอที่จะทำให้เกิดคู่ของอิเล็กตรอนที่ใช้ร่วมกันแต่ละอะตอมกับอะตอมใกล้เคียงได้

• สาเหตุของการเกิดพันธะโลหะ 1. โลหะมีค่าพลังงานไอออไนเซชั่นต่ำมาก แสดงว่าอิเลคตรอนของโลหะจะหลุดออกไปได้ง่าย เมื่อวา
เลนซ์อิเลคตรอนหลุดออกไป ก็จะเหลืออนุภาคบวกดังนี้

อะตอมโลหะทุกอะตอมจะเป็นตัวให้อิเลคตรอนทั้งสิ้นดังนั้นจะไม่มีอะตอมใดเลยที่ได้รับอิเลคตรอน
2. โลหะมีเวเลนซ์อิเลคตรอนน้อย ดังนั้นอิเลคตรอนที่หลุดออกไป จะมีเพียง 1, 2 หรือ 3 ตัวต่อ
อะตอม เท่านั้น
3. โลหะมีค่าโคออร์ดิเนชั่นนัมเบอร์สูง ซึ่งเท่ากับ 8 หรือ 12 หมายความว่า อะตอมหนึ่งจะมีอะตอม
อื่นรอบล้อม 8 ถึง 12 อะตอม ดังนั้นการนำอิเลคตรอนมาใช้ร่วมกันเป็นอิเลคตรอนคู่ในลักษณะของพันธะ
โคเวเลนท์จึงเป็นไปไม่ได้
ดังนั้นการเกิดพันธะโลหะควรเป็นไปในลักษณณะที่ว่า เวเลนซ์อิเลคตรอนของอะตอมโลหะที่หลุดออกไปจะไม่เป็นของอะตอมใดอะตอมหนึ่งโดยเฉพาะ แต่จะเป็นของอะตอมทั้งหมด โดยที่อิเลคตรอนจะเคลื่อนที่ไปยังอะตอมนี้บ้าง อะตอมโน้นบ้าง ในผลึกของโลหะจึงเป็นการเอาอนุภาคบวกมาเรียงกันไว้อย่างมีระเบียบ และมีเวเลนซ์อิเลคตรอนเคลื่อนที่ไปมาได้ทั่วอนุภาคบวกเหล่านั้นเหมือนกับเป็นหมอกปกคลุมอนุภาคบวกทั้งหมด หรืออาจกล่าวได้ว่า อนุภาคบวกเหล่านั้นจมอยู่ในทะเลอิเลคตรอน แรงดึงดูดระหว่างอนุภาคบวกกับอิเลคตรอนเรียกว่า "พันธะโลหะ" ซึ่งมีแรงยึดเหนี่ยวระหว่างพันธะแข็งแรงมาก

3.1 สมบัติของโลหะ
1. โลหะเป็นตัวนำไฟฟ้าที่ดี เพราะอิเล็กตรอนเคลื่อนที่ได้ง่าย
2. โลหะมีจุดหลอมเหลวสูง เพราะเวเลนต์อิเล็กตรอนของอะตอมทั้งหมดในก้อนโลหะยึดอะตอมไว้อย่างเหนียวแน่น
3. โลหะสามารถตีแผ่เป็นแผ่นบางๆได้ เพราะมีกลุ่มเวเลนต์อิเล็กตรอนทำหน้าที่ยึดอนุภาคให้เรียงกันไม่ขาดออกจากกัน
4. โลหะมีผิวเป็นมันวาว เพราะกลุ่มอิเล็กตรอนที่เคลื่อนที่โดยอิสระมีปฏิกิริยาต่อแสง จึงสะท้อนแสงทำให้มองเห็นเป็นมันวาว
5. สถานะปกติเป็นของแข็ง ยกเว้น Hg เป็นของเหลว
6. โลหะนำความร้อนได้ดี เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทาง

2.พันธะไอออนิก ( Ionic bond ) หมายถึง พันธะระหว่างอะตอมที่อยู่ในสภาพอิออนที่มีประจุตรงกันข้ามกัน ซึ่งเกิดจากการเคลื่อนย้ายอิเล็กตรอน 11 ตัว หรือมากกว่า จากอิเล็กตรอนวงนอกสุดของอะตอมหนึ่งไปยังอีกอะตอมหนึ่ง เพื่อให้จำนวนอิเล็กตรอนวงนอกสุด ครบออกเตต ซึ่งเกิดขึ้นระหว่างอะตอมของโลหะกับอโลหะ โดยที่โลหะเป็นฝ่ายจ่ายอิเล็กตรอนในระดับพลังงานชั้นนอกสุดให้กับอโลหะ เนื่องจากโลหะมีค่าพลังงานไอออไนเซชันต่ำ และอโลหะมีค่าพลังงานไอออไนเซชันสูง ดังนั้นพันธะไอออนิกจึงเกิดขึ้นระหว่างโลหะกับอโลหะได้ดี กล่างคือ อะตอมของโลหะให้เวเลนต์อิเล็กตรอนแก่อโลหะ แล้วเกิดเป็นไอออนบวกและไอออยลบของอโลหะ เพื่อให้เวเลนต์อิเล็กตรอนเป็นแปด แบบก๊าซเฉื่อย ส่วนอโลหะรับเวเลนต์อิเล็กตรอนมานั้นก็เพื่อปรับตัวเองให้เสถียรแบบก๊าซเฉื่อยเช่นกัน ไอออนบวกกับไอออนลบจึงดึงดูดระหว่างประจุไฟฟ้าต่างกันเกิดเป็นสารประกอบไอออนิก( Ionic compuond ) ดังนี้


การเกิดสารประกอบโซเดียมคลอไรด์ ( NaCl ) จากโซเดียม (Na) อะตอมกับคลอรีน (Cl) อะตอม
โซเดียมเสียอิเล็กตรอนให้แก่คลอรีน 1 ตัว ทำให้อะตอมของโซเดียมมีเวเลนต์อิเล็กตรอน= 8 (อะตอมจะเถียรเป็นไปตามกฎออกเตต) และทำให้มีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 1 ตัว ทำให้อะตอมโซเดียมแสดงอำนาจไฟฟ้าเป็นประจุบวก(+) ส่วนอะตอมคลอรีนรับอิเล็กจากโซเดียมมา 1 ตัว ทำให้อะตอมของคลอรีนมีเวเลนต์อิเล็กตรอน = 8 (อะตอมเสถียรเป็นไปตามกฎออกเตต) และทำให้มีจำนวนอิเล็กตรอนมากกว่าโปรตรอน 1 ตัว ทำให้อะตอมคลอรีนแสดงอำนาจไฟฟ้าเป็นประลบ(-)
โซเดียมอิออนบวก(+) และคลอไรด์อิออน (-) จะดึงดูดกัน เพราะมีประจุไฟฟ้าทีต่างกัน เกิดเป็น "พันธะไอออนิก"
การเกิดสารประกอบแมกนีเซียมคลอไรด์ จากแมกนีเซียมอะตอม(Mq) และคลอรีนอะตอม(Cl)
อะตอมแมกนีเซียมมีการจัดเรียงอิเล็กตรอนเป็น Mg = 2, 8, 2 แมกนีเซียมมีเวเลนต์อิเล็กตรอน = 2 ดังนั้นแมกนีเซียมจะจ่ายอิเล็กตรอนให้แก่คลอรีนอะตอม 2 ตัว เพื่อให้เวเลนต์อิเล็กตรอนเป็น 8 จึงจะเสถียรเหมือนก๊าซเฉื่อย ทำให้อะตอมของแมกนีเซียมมีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 2 ตัว จึงแสดงอำนาจไฟฟ้าเป็นประจุ 2+
แมกนีเซียมไอออนบวก(Mq 2+)และคลอไรด์ไอออนลบ(Cl -) จะเกิดแรงดึงดูดกัน เพราะมีประจุไฟฟ้าต่างกันเป็นโมเลกุลของแมกนีเซียมคลอไรด์


การเกิดพันธะไอออนิกในสารประกอบ แบเรียมออกไซด์ ( BaO )
การจัดเรียงอิเล็กตรอนของแบเรียม Ba = 2, 8, 18, 18, 8, 2 ( Ba มีเวเลนต์อิเล็กตรอน = 2 )และการจัดเรียงอิเล็กตรอนของออกซิเจน O = 2, 6 ( O มีเวเลนต์อิเล็กตรอน = 6 ) Ba เสียอิอล็กตรอนให้ O จำนวน 2 ตัว Ba จึงมีประจุเป็น 2+ ส่วน O ได้รับอิเล็กตรอนมา 2 ตัว จึงมีประจุไฟฟ้าเป็น 2- เกิดแรงยึดเหนี่ยวด้วยประจุไฟฟ้าต่างกัน เป็นโมเลกุลของแบเรียมออกไซด์
ลักษณะสำคัญของสารประกอบไอออนิก
1. พันธะไอออนิกเป็นพันธะที่เกิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl, MgO, KI
2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่าพลังงานไอออไนเซชันต่ำกับธาตุที่มีค่าพลังงานไอออไนเซชันสูง
3. พันธะไอออนิก อาจเป็นพันธะที่เกิดจากไอออบวกที่เป็นกลุ่มอะตอมของอโลหะ เช่น
4. สารประกอบไอออนิกไม่มีสูตรโมเลกุล มีแต่สตรเอมพิริคัล ( สูตรอย่างง่าย )
5.สารประกอบไอออนิกมีจุดดือดและจุดหลอมเหลวสูง
6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง ประกอบไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นอิออนและเคลื่อที่ได้ เกิดเป็นสารอิเล็กโทรไลดต์จึงนำไฟฟ้าได้
โครงสร้างของสารประกอบไอออนิก
โครงสร้างของสารประกอบไอออนิกมีลักษณะเป็นโครงผลึกร่างตาข่าย ประกอบด้วยไอออนบวกและไอออนลบสลับกัน ไม่สามารถแบ่งแยกเป็นโมเลกุลเดี่ยวๆได้ ดังนั้นจึงไม่สามารถทราบขอบเขตของไอออนของธาตุต่างๆใน 1 โมเลกุลได้ แต่สามารถหาอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบเท่านั้น จึงไม่สามารถเขียนสูตรโมเลกุลของสารประกอบไอออนิกได้ ใช้สูตรเอมพิริคัลแทนสูตรเคมีของสารประกอบไอออนิก สารประกอบไอออนิก
การเขียนสูตรและการเรียกชื่อสารประกอบไอออนิก
1. เขียนไอออนบวกของโลหะหรือกลุ่มไอออนบวกไว้ข้างหน้า ตามด้วยไอออนลบของอโลหะหรือกลุ่มไอออนลบ
2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นจึงต้องหาตัวเลขมาคูณกับจำนวนประจุบนไอออนบวกและไอออนลบให้มีจำนวนเท่ากัน แล้วใส่ตัวเลขเหล่านั้นไว้ที่มุมขวาล่างของแต่ละไอออน ซึ่งทำได้โดยใช้จำนวนประจุบนไอออนบวกและไอออนลบคูณไขว้กัน
3. ถ้ากลุ่มไอออนบวกหรือไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวาล่าง ดังตัวอย่าง
ข. การอ่านชื่อสารประกอบไอออนิก
1. สารประกอบธาตุคู่ ถ้าสารประกอบเกิดจาก ธาตุโลหะที่มีไอออนได้ชนิดเดียวรวมกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวก แล้วตามด้วยชื่อธาตุอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น
ไฮโดรเจน เปลี่ยนเป็น ไฮไดรด์ (hydride)
คลอรีน เปลี่ยนเป็น คลอไรด์ (chloride)
ไอโอดีน เปลี่ยนเป็น ไอโอไดด์ (iodide)
อออซิเจน เปลี่ยนเป็น ออกไซด์ (oxide)
ตัวอย่างการอ่านชื่อสารประกอบไอออนิกธาตุคู่
NaCl อ่านว่า โซเดียมคลอไรด์ (Sodium chloridr)
CaI2 อ่านว่า แคลเซียมไอโอไดด์ (Calcium iodide)
KBr อ่านว่า โพแทสเซียมโบรไมด์ (Potascium bromide)
CaCl2 อ่านว่า แคลเซียมคลอไรด์ (Calcium chloride)
FeCl2 อ่านว่า ไอร์ออน (II) คลอไรด์ ( Iron (II) chloride )
CuS อ่านว่า คอปเปอร์ (I) ซัลไฟด์ ( Cupper (I) sunfide )
FeCl3 อ่านว่า ไอร์ออน (III) คลอไรด์ ( Iron (III) chloride )
Cu2S อ่านว่า คอปเปอร์ (II) ซัลไฟด์ ( Copper (II) sunfide )
KNO3 อ่านว่า โพแทสเซียมไนเตรต (Potascium nitrae)
Ba(OH)2 อ่านว่า แบเรียมไฮดรอกไซด์ (Barium hydroxide)
(NH4)3PO4 อ่านว่า แอมโมเนียมฟอสเฟต (Ammomium pospate)
CaCO3 อ่านว่า แคลเซียมคาร์บอนเนต (Calcium carbonat)
การละลายของสารประกอบไอออนิก
สารประกอบไอออนิกบางชนิดละลายน้ำได้ดีและบางชนิดไม่ละลายน้ำ การที่สารประกอบไอออนิกละลายน้ำได้เนื่องจากแรงดึงดูดระหว่างโมเลกุลของน้ำกับไอออนมีค่ามากกว่าแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบ เช่น เมื่อนำโซเดียมคลอไรด์มาละลายในน้ำ แรงดึงดูดระหว่างโมเลกุลของน้ำกับโซเดียมไอออน และน้ำกับคลอไรด์ไอออนมีค่าสูงกว่าแรงยึดเหนี่ยวระหว่างไอออนทั้งสอง โซเดียมคลอไรด์จึงละลายน้ำได้ เมื่อไอออนเหล่านี้หลุดออกจากโครงสร้างเดิม แต่ละไอออนจะถูกล้อมรอบด้วยโมเลกุลของน้ำหลายๆโมเลกุล โดยน้ำจะหันขั้วที่มีประจุตรงกันข้ามเข้าไอออนที่ล้อมรอบ
ในการละลายน้ำของสารประกอบไอออนิก จะมีขั้นย่อยๆของการเปลี่ยนแปลง 2 ขั้นตอน ดังนี้
ขั้นที่ 1 ผลึกของสารประกอบไอออนิกสลายตัวออกเป็นไอออนบวกและลบในภาวะก๊าซ ขั้นนี้ต้องใช้พลังงานเพื่อสลายผลีก พลังงานนี้เรียกว่า พลังงานโครงร่างผลึก ( latece energy ) , E1
ขั้นที่ 2 ไอออนบวกและไอออนลบในภาวะก๊าซรวมตัวกับน้ำ ขั้นนี้มีการคายพลังงาน พลังงานที่คายออกมาเรียกว่า พลังงานไฮเดรชัน (Hydration energy ) , E2
พลังงานของการละลาย ( D E) มีค่า = E1 + E2 พลังงานของการละลายพิจารณาจากพลังงานโครงร่างผลึก ( E1 ) และพลังงานไฮเดรชัน ( E2 ) ดังนี้
1. ถ้าค่า D E< 0 ( E1 < E2 ) การละลายจะเป็นแบบคายพลังงาน
2. ถ้าค่าD E > 0 ( E1 > E2 ) การละลายจะเป็นแบบดูดพลังงาน
3. ถ้าD E = 0 ( E1 = E2 ) การละลายจะไม่คายพลังงาน
4. ถ้า พลังงานโครงร่างผลึกมีค่ามากกว่าพลังงานไฮเดรชันมากๆ ( E1 >>>> E2 ) จะไม่ละลายน้ำ
วันจันทร์ที่ 29 สิงหาคม พ.ศ. 2554
พันธะโควาเลนต์
1. พันธะโคเวเลนต์ (covalent bond)
เกิดจากการใช้อิเล็กตรอนร่วมกัน (share) ของอะตอมธาตุอโลหะ เพื่อทำให้อะตอมแต่ละอะตอมมีมีเวเลนซ์อิเล็กตรอนครบแปด หรือเหมือนแก๊สเฉื่อย
อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่า อะตอมคู่ร่วมพันธะ
ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะเดี่ยว เช่น ในโมเลกุลของน้ำ
ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะคู่ เช่น ในโมเลกุลของคาร์บอนไดออกไซด์
ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะสาม เช่น ในโมเลกุลของไนโตรเจน
วันพุธที่ 24 สิงหาคม พ.ศ. 2554
พันธะเคมี
พันธะเคมี คือแรงยึดเหนี่ยวระหว่างอะตอมภายในโมเลกุลหรือระหว่างโมเลกุลด้วยกันเองเพื่อทำให้วาเลนต์อิเล็กตรอนมีค่าเท่ากับแปด เพื่อที่จะทำให้อะตอมนั้น ๆ มีความเสถียรและสามารถดำรงค์อยู่อย่างอิสระ พันธะเคมีสามารถแบ่งได้หลายประเภท เช่น

- พันธะโควาเลนต์(covalent bond) คือการใช้วาเลนต์อิเล็กตรอนร่วมกัน อันเนื่องมาจากมีค่า EN (อิเล็กโตเนกาติวิตี) ใกล้เคียงกัน และเคลื่อนที่มาอยู่ในวงโคจรที่เหมาะสม และมีพลังงานศักย์ต่ำที่สุด
- พันธะโคออดิเนทโควาเลนต์
- พันธะโลหะ(Metallic bond)
- พันธะไอออนิก(Ionic bond) เกิดจากแรงดึงดูดระหว่างไอออนบวกและไอออนลบ อันเนื่องมาจากการถ่ายโอนอิเล็กตรอนระหว่างโลหะกับอโลหะ
- พันธะไฮโดรเจน(hydrogen bonds)

สมัครสมาชิก:
บทความ (Atom)